Что касается молекулярного давления, то ввиду наличия зависимости pm=y(z) его величину также следует представлять себе как результат суммирования элементарных сил по толщине r от переходного слоя [1].
До последнего времени не было найдено метода измерения молекулярного давления. Решение этой задачи встречает большие трудности, так как молекулярное давление по его происхождению связано с взаимодействиями молекул переходного слоя чрезвычайно малой толщины (~10-7 см) по всей поверхности фазы. Молекулярное давление доступно, однако, вычислению:
![]() , (3)
, (3)
где pBH – внешнее давление, I – механический эквивалент, Ср и Сu - молярные теплоёмкости при постоянном давлении и объёме, g - термический коэффициент объёма u. Величина pm может быть также вычислена на основании уравнения Ван-дер-Ваальса, если известны его константы.
Изменение молекулярного давления для жидкостей и твёрдых тел охватывает три порядка: 10-3¸10-5 атм. Индивидуальные вариации величины pm являются прямым следствием индивидуальных различий атомных и молекулярных структур вещества. Поэтому молекулярное давление может служить надёжным критерием интенсивности молекулярного взаимодействия.
Если известна зависимость f=y(z), то можно подсчитать работу выхода молекулы на поверхность фазы. Максимальная работа выхода [14]:
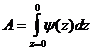 . (4)
. (4)
Таким образом, увеличение поверхности связано с затратой работы; при сжатии поверхность сама совершает работу. Из этих термодинамических предпосылок и вытекает представление о поверхностном натяжении как тангенциальных силах, совершающих работу при изменении величины поверхности. Для фазовых поверхностей, имеющих кривизну, ещё Лапласом было введено представление о капиллярном дополнительном давлении р как тангенциальных силах, действующих на поверхностный слой фазы таким образом, что их результирующая направлена к центрам кривизны поверхности [14]:
![]() . (5)
. (5)
Действительно, наблюдаемые на опыте поверхностные явления протекают таким образом, как если бы поверхность находилась в состоянии квазиупругого натяжения. Такое представление весьма наглядно и облегчает решение многих задач.
Однако никакой действительной аналогии между поверхностным и упругим натяжением не существует, так как закон Гука по отношению к поверхностному натяжению не выполняется: величина деформации поверхности не зависит от s, которое в изометрических условиях изометрической величины поверхности остаётся постоянным.
К сожалению общепринятой теории возникновения поверхностных сил не существует. Имеющиеся точки зрения сводятся к следующим:
1) Выдвигается гипотеза, утверждающая, что межмолекулярные взаимодействия благодаря особой ориентации как самих молекул в поверхностном слое, так и их полей осуществляются преимущественно в направлении, тангенциальном к поверхности. Благодаря такой особой структуре поверхностного слоя возникают силы поверхностного натяжения. Иначе говоря, согласно этой точки зрения существует особая анизотропия молекулярных сил в поверхностном слое, а происхождение этих сил может быть связано с лондоновским (обменным) взаимодействием ван-дер-ваальсового типа.
2) Падение давления в жидкости по толщине поверхностного слоя при постоянном переходе от жидкости к пару, численно равное свободной поверхностной энергии, служит причиной поверхностного натяжения (Беккер) [2].
Обе эти точки зрения при их развитии наталкиваются на серьёзные трудности.
3) Н. Адам, наконец, считает, что понятие поверхностного натяжения имеет смысл лишь математического эквивалента поверхностной энергии [2]. Введение понятия поверхностного натяжения он сопоставляет с принципом возможных перемещений в статике, как чисто математическим приёмом. Так как наличие свободной энергии поверхности может быть объяснено молекулярным давлением, то, по Адаму, нет надобности задаваться вопросом, каким образом это приводит к возникновению тангенциальных сил поверхностного натяжения.
 Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
 Законы физики основаны на фактах, установленных опытным путем.
Законы физики основаны на фактах, установленных опытным путем.
 Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.
Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.